시행일 이전 제조·수입 의약품도 2018년 12월 3일부터 적용

[한국정책신문=김소희 기자] '의약품 전 성분 표시 제도'가 오늘 12월 3일부터 시행됨에 따라 관련업계의 주의가 요구된다.
의약품 등의 전 성분 표시 제도는 의약품과 의약외품의 용기·포장에 품목허가증 및 품목신고증에 기재된 모든 성분의 명칭, 유효 성분의 분량과 보존제의 분량 기재를 의무화한 제도다.
한국제약바이오협회는 29일 "법 시행일 이후 제조·수입한 의약품은 당장 올해 12월부터 전 성분 표시제를 적용받는다. 때문에 포장 등 제조공정상의 사전 준비가 필요하다"고 당부했다.
협회에 따르면 개정 약사법(법률 제14328호)상 의약품과 의약외품의 전 성분 표시제는 시행일 이후 제조·수입하는 의약품부터 적용받는다.
시행일 이전 제조·수입한 의약품은 경과규정에 따라 시행 1년 후인 2018년 12월 3일부터 적용받는다.
국내 제조품목은 완제의약품 제조일자가, 수입의약품은 수입일(통관일)이 적용 시점의 기준이 된다.
다만 △포장단위 10정·캡슐 이상의 내용고형제 △첩부제, 카타플라스마제에 해당되는 일반의약품은 2019년 1월 1일 이후 제조·수입하는 의약품부터 적용된다.
세부 기재방법은 '의약품 표시 등에 관한 규정 개정안'에 따라 원료약품 및 그 분량은 유효성분, 첨가제 순으로 구분해 기재해야 한다.
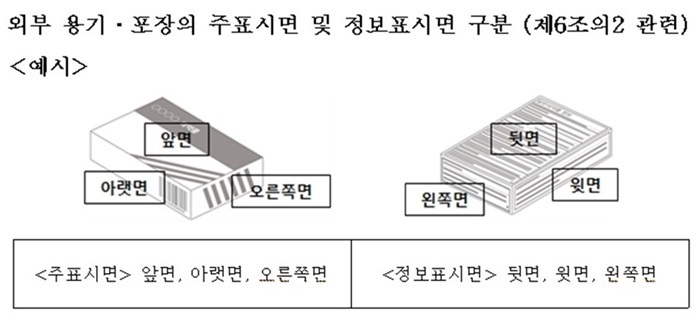
일반의약품 중 △안전상비약 △포장단위 10정·캡슐 이상의 내용고형제 △첩부제, 카타플라스마제는 외부 용기·포장에 주표시면과 정보표시면을 구분해 표시해야 한다.
단, △의사 또는 치과의사의 처방전에 의해 조제되는 일반의약품으로 '조제용'으로 표시된 의약품 △정제·캡슐제를 제외한 내용량이 50g 이하 또는 50ml 이하의 의약품 △1회용 포장 의약품(정제·캡슐제만 해당) 등은 제외된다.
주표시면에는 △의약품 품목허가를 받은 자 또는 수입자의 상호 △제품명 △중량 또는 용량이나 개수 △일반의약품 △일반(안전상비)의약품 등을 기재한다.
정보표시면에는 △품목허가증 및 품목신고증에 기재된 모든 성분(유효성분이 분명하지 아니한 것은 그 본질 및 그 제조방법의 요지)의 명칭 △유효성분의 분량 및 보존제의 분량 △효능·효과 △용법·용량 △사용 또는 취급할 때에 필요한 주의사항 △저장방법 △유효기한 또는 사용기한 등을 기재해야 한다.
이외 별도로 정하지 않은 사항은 모든 면에 표시할 수 있다.

